讓“瑞德西韋”再飛一會
“2020年3月24日,美國食品和藥品管理局(FDA)發布消息:批準認證美國吉利德(Gilead)科學公司的Remdesivir(瑞德西韋)孤兒藥認證,適應癥為新型冠狀病毒病(COVID-19)。”
目前,新型冠狀病毒肺炎(Coronavirus Disease 2019,COVID-19)正肆無忌憚的在世界蔓延,截至3月24日,世衛組織總干事譚德塞在會上宣布,全球新冠肺炎累積確診近40萬例(國外累積確診超30萬),幾乎每個國家都已出現新冠肺炎病例,而且蔓延速度還在加快。從確診首例新冠肺炎到全球病例數量達到10萬花了67天時間,而達到第二個10萬僅用了11天,第三個10萬僅用了4天。這當中除了各個國家面對新冠肺炎的態度“傲慢”之外,也和病毒檢測力度的加大以及病毒本身的特點有關。

圖1: 國外累計確診/現有確診(數據來源百度疫情大數據,截至2020.3.23)
研究顯示,新冠肺炎病毒是一種與SARS有高度同源性的新病毒(基因組相似性達到79.5%),而且與SARS冠狀病毒識別同樣的受體(ACE2)進入細胞,在遺傳距離上和SARS冠狀病毒同屬SARS相關冠狀病毒種,但是它們的病原生物學特性有差異很大,分屬于兩個不同的病毒,算是SARS病毒中的兩兄弟,被命名為SARS-CoV-2。
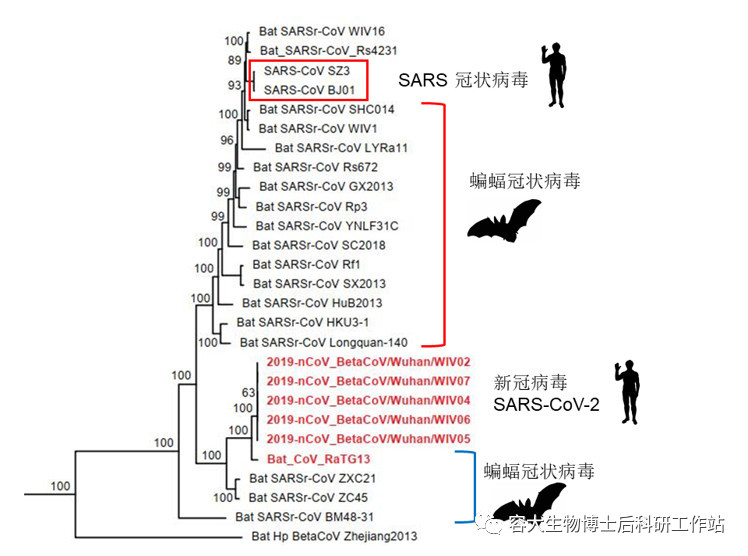
圖2:基于SARS相關冠狀病毒全長基因組序列的系統發育樹(來自:Nature 579, 270–273 (2020))
遏制病毒蔓延,除了必須做好防護和隔離措施以外,相關藥物的干預、治療以及研發至關重要。目前新冠病毒藥物或疫苗研發或臨床應用的好消息不斷,包括國內、國外,相信這都得益于不同科研結構和科學家的全力介入,這都有助于更好的認識這個病毒,并充分了解它的感染機制,從而對特效藥物的研制、臨床使用和疫苗的開發帶來指導性的幫助。
針對病毒的侵染細胞的過程,抗病毒藥物主要集中在病毒進入細胞前(細胞水平),以及進入細胞后的復制過程(基因水平),這也是科技部2月15日公布的三個用于開展三期臨床試驗治療新冠肺炎西藥(氯喹、法匹拉韋、瑞德西韋)的主要抗病毒靶點,相關臨床結果將于4月27號公布。
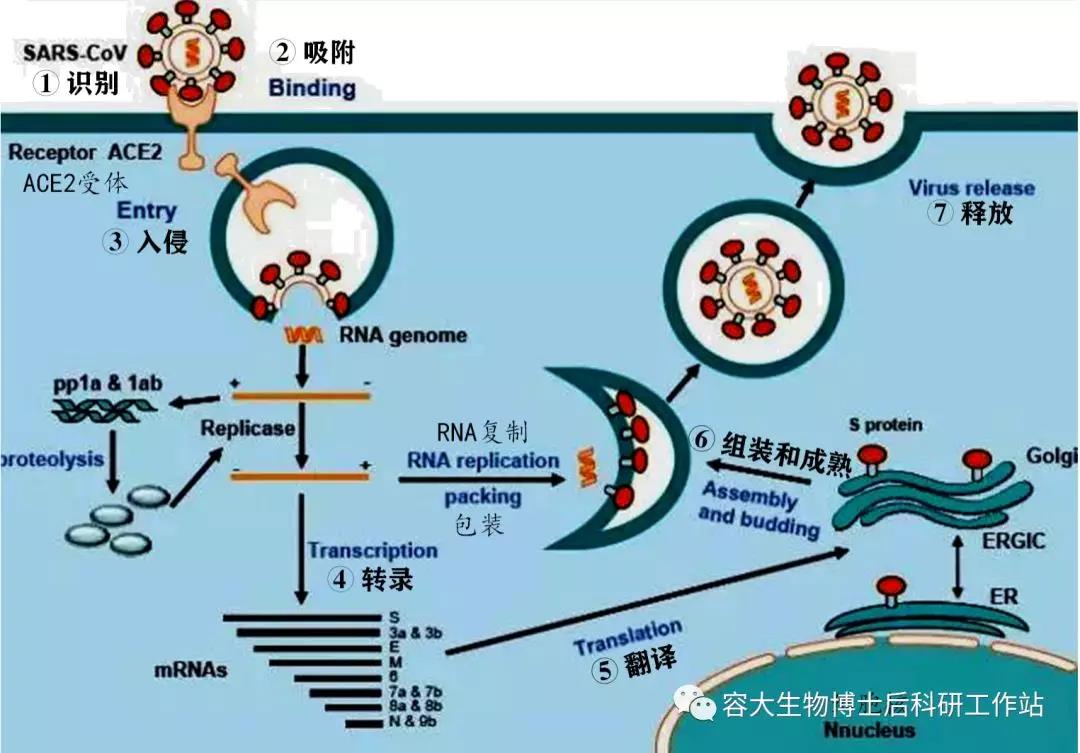
圖3:SARS病毒侵染細胞的生活周期
而其中核苷類似物“瑞德西韋”備受關注,這不僅因為他的英文名(Remdesivir)有“人民的希望”的諧音,更因為它展現的廣譜的抗病毒潛力。
瑞德西韋作為一款在研藥物,目前并沒有在任何國家上市。其對新冠肺炎治療效果的報道也首先見諸于美國。2020年1月份,權威醫學期刊《新英格蘭醫學雜志》(NEJM)報道了美國首例確診病例在使用瑞德西韋后臨床癥狀出現了明顯的改善。
在新冠肺炎確診患者持續增加的現實之下,瑞德西韋似乎真正成為了“美國人民的希望”。
“2020年3月24日,美國食品和藥品管理局(FDA)發布消息:批準認證美國吉利德(Gilead)科學公司的Remdesivir(瑞德西韋)孤兒藥認證,適應癥為新型冠狀病毒病(COVID-19)。”

所謂的孤兒藥(Orphan Drug),指一些專門用于治愈或治療/控制罕見病的藥物的稱呼,獲此認證的研究項目可走FDA綠色通道,加速上市審批的流程。更需要注意的是,孤兒藥身份可以為制藥公司提供在該適應癥上為期7年的市場獨占期,即7年內任何藥廠不得仿制該藥物用于在獲批適應癥領域進行治療。

之前和大家探討過瑞德西韋的化學結構,其本質上也是一種核苷類似物。它的主要機制在于在基因水平對病毒的生活周期進行阻斷。類似物可作為一名“偽裝者”冒充核苷混入病毒遺傳物質(DNA或RNA)的合成過程,癱瘓病毒遺傳物質的復制過程,從而產生抗病毒作用。 (點擊“從瑞德西韋治療病毒性疾病的療效看蟲草素未來”閱讀原文)
瑞德西韋正是作為一類腺嘌呤核苷的類似物,進入細胞后首先被磷酸化為三磷酸核苷,成為三磷酸腺苷的類似物,欺騙關鍵性的RNA依賴性的聚合酶(RNA-dependent RNA polymerase,RdRp),使得病毒在復制過程中將其作為普通的核苷酸加入RNA鏈中,但這時“偽裝”的核苷酸無法讓正常的RNA鏈繼續延伸完成復制,致使病毒的生命周期受阻,從而達到治療COVID-19的目的。

從瑞德西韋看另一類腺苷類似物——蟲草素
廣義來講,核苷類似物理論上講都有可能抑制病毒的復制(不管是RNA病毒還是DNA病毒,復制、遺傳都是基礎),從而對病毒的生命形式進行干擾。目前己上市的及應用于臨床的抗病毒藥物中,核苷類化合物超過半數。但并不是所有的核苷類似物單體都具有開發成為抗病毒藥物的潛力,其中關鍵的還是不同類似物單體本身存在的不穩定性(耐藥性)、毒性以及病毒聚合酶對類似物的識別概率。
蟲草素作為一種天然的RNA聚合酶抑制劑,是來自于蟲草屬真菌的一種具有生物活性的核苷類似物,天然蟲草素(3‘-脫氧腺苷,屬腺苷類似物)與瑞德西韋在結構上有很多相似之處。
相較蟲草素單體而言,瑞德西韋在核苷的主體部位同時對堿基和糖基進行了雙重修飾(堿基的碳碳鏈接和糖基的氰鍵,圖中紅色虛線圈所示),分子量也變得更大了,這都是為了增加此類藥物單體在細胞中的穩定性和延長半衰期。
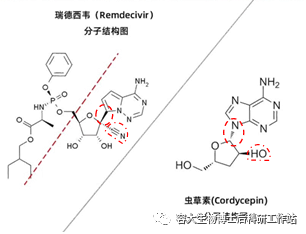
圖4:瑞德西韋與蟲草素結構對比
說到蟲草素就難免讓人會想到冬蟲夏草,其實這兩個東西差別還是蠻大的,蟲草素是某些蟲草屬真菌的天然代謝產物,但其中冬蟲夏草作為蟲草屬真菌的一類,其并不會合成或者說是不能積累蟲草素。
其實,作為腺苷類似物的蟲草素具有比瑞德西韋更好的細胞吸收性(親水性能更好,分子也更小),不僅可抑制RNA依賴的聚合酶活性,還能夠抑制DNA轉錄mRNA過程中的成熟障礙,有效抑制DNA病毒的復制和成熟(流行了100多年的非洲豬瘟病毒(ASFV)就是一種獨特的雙鏈DNA病毒),最終達到抗病毒的效果。
那為什么單體的蟲草素不能作為病毒的治療藥物呢?這其實和蟲草素的性質有關,天然蟲草素單體在沒有保護劑的情況下,在動物細胞內會很快的被腺苷脫氨酶作用而生產無活性的成分,只有少部分的能夠形成有活性的三磷酸蟲草素,致使它單獨在體內使用時無法維持一定的濃度,而這些在使用含有一定含量蟲草素的復合蟲草培養物中能夠得到極大的改善。
我們目前飼料目錄中的唯一的蟲草類飼料添加劑便是蟲草屬真菌——地頂孢霉培養物(農業部公告第686號),一種動物能夠吃的“蟲草”。
地頂孢霉培養物中不僅含有蟲草素,還含有的豐富的核苷類保護成分,能夠有效的分擔蟲草素的體內失活效應,同時作為細胞誘導因子能夠有效的激活細胞腺苷激酶的轉錄,促進蟲草素的磷酸化。
不僅如此,蟲草培養物中含有的豐富糖苷鍵類型的β-蟲草多糖以及蟲草酸等生物活性成分,能夠改善腸黏膜免疫和菌群組成,雙向調節免疫,與蟲草素形成“集團”力量,幫助動物機體建立免疫防線,對病毒形成“從點到面”的攻擊,從而維護機體健康。
But,
不同地頂孢霉菌株,培養物組成及活性成分含量差異巨大!
容氏蟲草素(通用名:地頂孢霉培養物)是通過對野生型地頂孢霉菌株進行超進化定向選育,結合高通量篩選獲得的地頂孢霉專利菌株(ZL 201610571224.7),利用生物發酵實現生物活性物質的高效積累,賦于天然活性結構、全效易吸收,讓動物吃得起“好蟲草”。
本文由容大生物博士后科研工作站原創,僅用于學術分享,轉載請注明出處。





